Cirugía en cáncer epitelial de ovario
Prof (Asist) Dr. Clemente Arab Eblen.
Unidad de Ginecología Oncológica Hospital Luis Tisné B- CRS Cordillera Oriente.
Universidad de Chile.
En estadiaje inicial la recomendación de la FIGO (Federación Internacional de Ginecología y Obstetricia)1 , de la European guidelines for staging ovarian cancer de la EORTC, Sociedad Española de Ginecología y Obstetricia (SEGO) y del grupo americano (GOG)2,3, es:
- Citología del líquido ascítico o lavados peritoneales (cúpula diafragmática derecha, pelvis y ambos parietocólicos)
- Inspección y palpación de peritoneo y biopsias peritoneales (en especial de las áreas sospechosas o mínimo en ambos parietocólicos, fondo pélvico y cúpula diafragmática derecha).
- Exéresis completa del anexo tumoral (Fig.1).
- Histerectomía total tipo A o extrafascial, y anexectomía contralateral (Fig.2).
- Liberación y adherencias de las zonas adyacentes al tumor primario.
- Omentectomía total o infracólica (Fig.3).
- Apendicectomía en el tipo histológico mucinoso1.
- Linfadenectomía pélvica bilateral incluyendo la fosa obturatriz y linfadenectomía para-aórtica4 hasta la altura de la vena renal izquierda (Fig. 4 y 5).
- En estadios IA G1 1,5,6, puede resultar aceptable conservar el anexo sano y el útero con finalidad reproductiva, sin que ello deba mermar en la práctica el resto de la estadificación quirúrgica reglada.
De acuerdo a los últimos datos observados tras 10 años de seguimiento del estudio ICON 1 y ACTION, la quimioterapia adyuvante en pacientes con enfermedad precoz y cirugía estadificadora completa no aporta a la supervivencia7. Un enfrentamiento quirúrgico adecuado en estadiaje inicial evita la quimioterapia y define las pacientes que sí se beneficiarán de adyuvancia.
El tema es que la mayoría de las mujeres con cáncer de ovario se presentan en estadios avanzados.
Desde los años 70 se ha sostenido que la cirugía primaria de máximo esfuerzo es factor pronóstico en cáncer de ovario avanzado (COAv)8,9,10. Bristow en un meta-análisis que incluye un poco más de 6800 pacientes, observa que por cada 10% en el incremento de la citorreducción quirúrgica, aumenta en un 5.5% la supervivencia11.
Los porcentajes de cirugía de citorreducción primaria (CCP) completa en COAv dependiendo del país y la Institución, oscilan entre un 15 y 90%. Un estudio americano observa un 54% de citorreducción óptima cuando se realiza cirugía primaria en COAv12 , lo que revela que tras 30 años de un fellowships, el problema sigue siendo para el Ginecólogo Oncólogo el manejo quirúrgico del compartimento supramesocólico.
Existe numerosa evidencia científica que apoya el manejo del COAv irresecable con quimioterapia neoadyuvante (QMTN) seguida de cirugía de intervalo como alternativa frente a la CCP13,14.
Entre las ventajas de la QMTN se encuentra el que se logra cirugía de intervalo óptima en la gran mayoría de los casos, menor morbilidad quirúrgica y estancia hospitalaria, además de excluir de cirugía al grupo de pacientes quimioresistentes15.
Los resultados del estudio prospectivo randomizado Europeo en colaboración con el Instituto Nacional del Cáncer de Cánada (EORTC 55971) que compara la QMTN seguida de cirugía de intervalo versus CCP y quimioterapia adyuvante dan cuenta de una supervivencia similar, pero con menor morbimortalidad postoperatoria a favor de la rama de QMTN16.
Se consideran como criterios de irresecabilidad, y por ende, indicación de QMTN: enfermedad diafragmática extensa, metástasis a nivel del parénquima hepático (Fig.6) compromiso a nivel del porta hepatis, infiltración conjunta de la curvatura mayor del estómago, colon transverso y bazo (Fig.7), compromiso del hilio mesentérico, adenopatías suprarrenales y extensa invasión de la serosa intestinal con necesidad de resección intestinal mayor a 1.5 metros17,18,19,20,21,22.
El uso de la laparoscopía como pre-look en COAv ha sido determinante en lograr seleccionar las pacientes que se beneficiarán de QMTN ya que representa el mejor factor predictor de resecabilidad23,24. La incorporación de la biopsia bajo ecografía, como alternativa a la laparoscopía en pacientes seleccionadas ha disminuido los intervalos de tiempo entre la sospecha diagnóstica y el inicio del tratamiento, fundamental en COAv25 (Fig.8).
Actualmente en nuestra Institución se registra un 60% de QMTN en COAv24. Esta estrategia de manejo en CAOv se inicio en el año 2008, permitiendo tener cifras de citorreducción óptima del 91% y 88% en CCP y de intervalo respectivamente. Con un tiempo de seguimiento de 27,2 meses se ha observado una esperanza de vida de 24 meses en CCP y de 18 meses en QMTN, no encontrándose diferencias significativas en la supervivencia de ambos grupos26 (Fig.9).
Las Instituciones son factor pronóstico en COAv. Si no se logran cifras de CCP óptima mayores a un 50% en conformidad a las recomendaciones internacionales , la QMTN podría ser la estrategia a desarrollar.
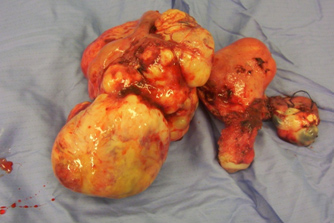
Figura 1. Exéresis completa del anexo tumoral.
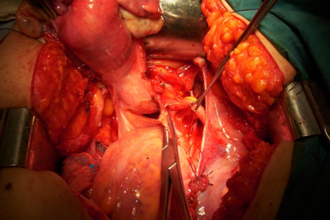
Figura 2. Histerectomía total tipo A o extrafascial.
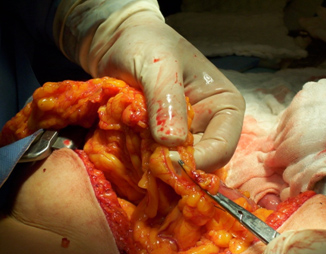
Figura 3. Omentectomía infracólica.
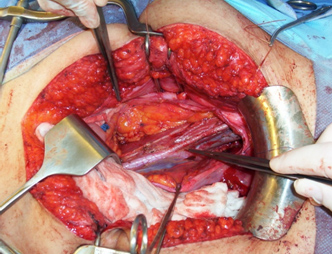
Figura 4. Linfadenectomía pélvica.
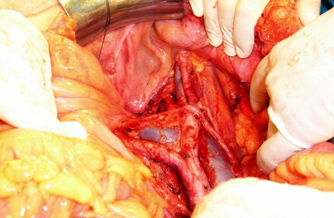
Figura 5. Linfadenectomía para-aórtica.
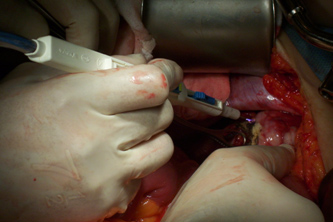
Figura 6. Metástasis del parénquima hepático.
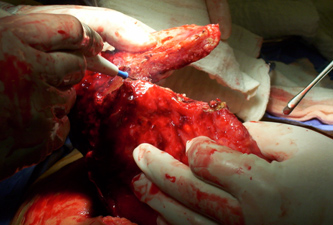
Fig 7. Omento en coraza. Infiltración conjunta de la curvatura mayor del estómago y colon transverso.
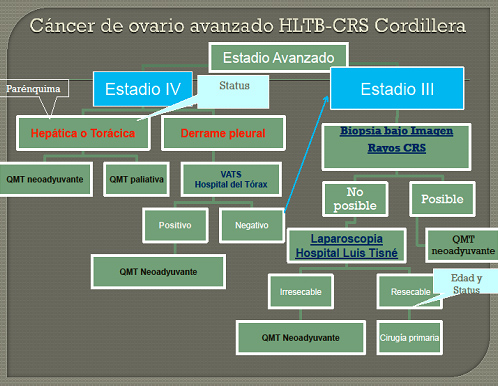
Figura 8. Enfrentamiento del COAv en Hospital Luis Tisné B- CRS Cordillera25.
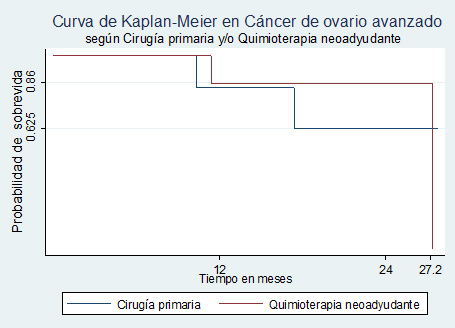
Fig 9. Curva de supervivencia en COAv Hospital Luis Tisné B-CRS Cordillera26.
REFERENCIAS
1Benedet J.L, Bender, Jones III H, Ngan H.Y.S, Pecorelli S. FIGO Committe on Gynecologic Oncology. Staging classifications and clinical practice guidelines of gynaecologic cancers. Int J Gynecol Obstet 2000; 70: 207-312.
2Protocolo SEGO. Tumores Epiteliales Malignos del Ovario.
3Colombo N, Chiari S, Maggioni A, Bocciolone L, Torri V, Mangioni C. Controversial issues in the management of early epithelial ovarian cancer: conservative surgery and role of adjuvant therapy. Gynecol Oncol 1994; 55:S47-S51.
4Pereira A, Magrina JF, Rey V, Cortes M, Magtibay PM. Pelvic and aortic lymph node metastasis in epithelial ovarian cancer. Gynecol Oncol 2007;105(3):604-8.
5Morice P, Leblanc E, Rey A, Baron M, Querleu D, Blanchot J et al; GCCLCC and SFOG. Conservative treatment in epithelial ovarian cancer: results of a multicentre study of the GCCLCC (Groupe des Chirurgiens de Centre de Lutte Contre le Cancer) and SFOG (Societe Francaise d'Oncologie Gynecologique). Hum Reprod 2005; 20:1379-85.
6Morice P, Wicart-Poque F, Rey A, El-Hassan J, Pautier P, Lhomme C et al. Results of conservative treatment in epithelial ovarian carcinoma. Results of conservative treatment in epithelial ovarian carcinoma.
Cancer 2001; 92:2412-8.
7Trimbos B, Timmers P, Pecorelli S, Coens C, Ven K, van der Burg M, et al. Surgical staging and treatment of early ovarian cancer: long-term analysis from a
randomized trial. J Natl Cancer Inst 2010;102 (13):982-7.
8Griffiths CT. Surgical resection of tumor bulk in the primary treatment of ovarian carcinoma. Natl Cancer Inst Monogr 1975; 42:101-4.
9Smith JP, Day TG Jr. Rewiew of ovarian cancer at the University of Texas Systems Cancer Center, M.D. Anderson Hospital and Tumor Institute. Am J Obstet Gynecol 1979;135 (7):984-93.
10Aure JC, Hoeg K, Kolstad P. Clinical and histologic studies of ovarian carcinoma. Long-term follow-up of 990 cases. Obstet Gynecol 1971; 37 (1):1-9.
11Bristow RE, Tomacruz RS, Armstrong DK, Trimble EL, Montz FJ. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis. J Clin Oncol 2002;20(5):1248-59.
12Everett EN, French AE, Stone RL, Pastore LM, Jazaeri AA, Andersen WA et al. Initial chemotherapy followed by surgical cytoreduction for the treatment of
stage III/IV epithelial ovarian cancer. Am J Obstet Gynecol 2006;195(2):568-74; discussion 574-6.
13van der Burg ME, van Lent M, Buyse M, Kobierska A, Colombo N, Favalli G et al.
The effect of debulking surgery after induction chemotherapy on the prognosis in advanced epithelial ovarian cancer. Gynecological Cancer Cooperative Group of the European Organization for Research and Treatment of Cancer. N Engl J Med 1995;332:629-34.
14Rose PG, Nerenstone S, Brady MF, Clarke-Pearson D, Olt G, Rubin SC, et al. Gynecologic Oncology Group A phase III randomised study of interval secondary cytoreduction in patients with advanced stage ovarian carcinoma with suboptimal residual disease: a Gynecologic Oncology Group study. Proc ASCO 2002; 21: 201a. Abstract 802.
15Vergote I, Van Gorp T, Amant F, Leunen K, Neven P, Berteloot P. Timing of debulking surgeryin advanced ovarian cancer. Int J Gynecol Cancer 2008; 18 Suppl 1: 11-19.
16Vergote I, Tropé CG, Amant F, Kristensen GB, Ehlen T, Johnson N et al ; European Organization for Research and Treatment of Cancer-Gynaecological Cancer Group; NCIC Clinical Trials Group. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N Engl J Med 2010; 363(10):943-53.
17Lu KF, Köse MF, Boran N, Caliskan E, Tulunay G. Neoadjuvant chemotherapy or primary surgery in advanced epithelial ovarian carcinoma. Int J Gynecol Cancer 2001;11: 466–70.
18Vergote I, De Wever I, Tjalma W, Van Gramberen M, Decloedt J, Van Dam P. Neoadjuvant chemotherapy or primary debulking surgery in advanced ovarian carcinoma: a retrospective analysis of 285 patients. Gynecol Oncol 1998; 71:431-6.
19Chan YM, Ng TY, Ngan HYS, Wong LC. Quality of life in women treated with neoadjuvant chemotherapy for advanced ovarian cancer: a prospective longitudinal study. Gynecol Oncol 2002;88: 9–16.
20Fanfani F, Ferrandina G, Corrado G, Fagotti A, Zakut HV, Mancuso S et al. Impact of interval debulking surgery on clinical outcome in primary unresectable FIGO Stage IIIc ovarian cancer patients. Oncology 2003;65:316–22
21Morice P, Dubernard G, Rey A, Atallah D, Pautier P, Pomel C et al. Results of interval debulking surgery compared with primary debulking surgery in advanced stage ovarian cancer. J Am Coll Surg 2003;197: 955–63.
22Giannopoulos T, Butler-Manuel S, Taylor A, Ngeh N, Thomas H. Clinical outcomes of neoadjuvant chemotherapy and primary debulking in advanced ovarian carcinoma. Eur J Gynaecol Oncol 2006; 27:25–8.
23Angioli R, Palaia I, Zullo MA, Muzii L, Manci N, Calcagno M et al. Diagnostic open laparoscopy in the management of advanced ovarian cancer. Gynecol Oncol 2006; 100(3):455-61
24Arab C, Junemann K, Aedo S, Tobar P. Abordaje laparoscópico y neoadyuvancia en cáncer de ovario avanzado. Publicado en el libro de contribuciones del XXXII Congreso Chileno de Obstetricia y Ginecología 2009.
25Sandoval G, Cano F, Arab C. Biopsia guiada por ecografía y quimioterapia neoadyuvante en cáncer de ovario avanzado. Rev Obstet Ginecol Hosp Santiago Oriente Dr. Luis Tisné Brousse 2011; 6 (1): 31-34.
26Arab C, Aedo S, Cano F. Quimioterapia neoadyuvante en cáncer de ovario avanzado II Congreso Chileno de Ginecología Oncológica. 14-16 de Noviembre de 2010.
27Verleye L, Ottevanger PB, van der Graaf W, Reed NS, Vergote I; Gynaecological
Cancer Group (GCG) of European Organisation for Research and Treatment of Cancer
(EORTC). EORTC-GCG process quality indicators for ovarian cancer surgery. Eur J Cancer 2009;45(4):517-26.