Insuficiencia venosa superficial de las extremidades inferiores

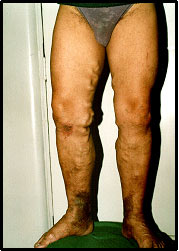
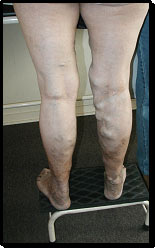
Las consultas por várices de las extremidades inferiores son extraordinariamente frecuentes tanto en la Medicina pública como en la privada. La información que se proporciona a los pacientes por regla general es muy variada, poco precisa y errónea. Habitualmente los médicos, al igual que el público en general, consideran que las venas dilatadas constituyen un problema banal que preocupa a los que las presentan más por motivos cosméticos que por reales molestias.
Sin embargo, la demanda de atención y las prolongadas listas de espera debieran preocupar en forma creciente a nuestras autoridades de salud y por supuesto, a todos los médicos. ¿Qué nos dice la Epidemiología en cuanto a la real frecuencia de esta enfermedad? De la partida, no hay estudios nacionales al respecto, como tampoco los hay en el resto de América Latina. Conocemos algunos sobre barrios industriales en Sao Paulo, pero no pueden extrapolarse a la población de todo el país. Hay estudios en todos los otros continentes, cuya frecuencia es tan dispar como del 10% sobre la población general hasta el 50% en el país de Gales (1). Esta disparidad puede explicarse por las variadas definiciones de qué constituye una vena varicosa. Algunas estadísticas consideran toda vena o vénula dilatada, lo cual incluiría las telangiectasias (arañas vasculares), con lo cual aumentan extraordinariamente la frecuencia, mientras que otros consideran sólo las llamadas várices tronculares.
La mayoría de los autores aceptan la definición que considera como várice toda vena dilatada, elongada, tortuosa y con insuficiencia valvular, sin considerar su tamaño (2). Probablemente nuestra frecuencia se asemeje a la de España (Jiménez Cossío) que atribuye 15% a los hombres y 25-30% a las mujeres en la población mayor de 18 años.
Etiología
Siendo conocidas y descritas las várices desde la Antigüedad, sobran las teorías sobre su causa que no han resistido el paso del tiempo. Algunos aspectos de la práctica clínica son ampliamente conocidos y aceptados. Cualquier teoría debe considerarlos y explicarlos. Ellos son el carácter hereditario, la influencia hormonal, la suficiencia valvular y el efecto de la bomba músculo aponeurótica de la extremidad inferior.
Al efectuar la anamnesis, siempre encontramos antecedentes familiares de várices más o menos cercanos. Se discute si se trataría de un gen recesivo o dominante, pero es indudable el carácter hereditario de esta afección. El gen defectuoso se expresaría en una alteración del colágeno o la elastina de la pared venosa, o de ambos. Dicha alteración afectaría todas o ciertas regiones de las extremidades, lo que explicaría porqué a veces aparecen várices predominantemente en un miembro o en un sector de él (3).
La influencia hormonal femenina es muy clara en esta afección. Generalmente las pacientes relatan la aparición de sus várices durante un embarazo, con frecuencia en el primer trimestre. En ese momento el útero todavía no alcanza un tamaño que justifique la compresión de las venas pélvicas.
Luego esta aparición sólo puede deberse a una acción hormonal. Sabemos que la progesterona provoca aumento de la distensibilidad de la pared venosa y por lo tanto, de la capacitancia venosa. Este efecto se corresponde con dilatación de los vasos no sólo durante el embarazo, sino que también es muy notorio al comienzo del ciclo menstrual. La progesterona inhibe la contractibilidad del músculo liso de los vasos venosos y provoca su dilatación en el subdermis, donde provocan la distensión de los plexos nerviosos somáticos adyacentes. Ello causa el dolor y la sensación de pesantez característica de las pacientes varicosas, que se alivia con el decúbito y la elevación de las extremidades.
Esta dilatación puede ocasionar también que una válvula previamente continente en forma súbita se suelte y se haga insuficiente, provocando la aparición de un racimo de telangiesctasias o de un paquete varicoso. Este fenómeno es más frecuente a nivel de las perforantes en las piernas o en la cara externa de muslos y piernas.
Sobre estas venas con resistencia disminuida y bajo acción hormonal, actúan 2 factores hidrodinámicos: el peso de la columna de sangre en conductos con válvulas incontinentes y la acción deficitaria de la bomba periférica, que afecta la presión muscular ejercida sobre las venas de la extremidad.
La posición erecta de la humanidad ha sido considerada culpable de la aparición de várices en los miembros inferiores, desconocidos en todas las otras especies. Es de toda lógica que válvulas con velos cortos o inexistentes produzcan una columna de sangre desde la aurícula hasta la región maleolar excesivamente pesada que aumentará considerablemente la presión venosa.
Esta fuerza ejercida sobre paredes genéticamente débiles provocará dilatación, elongación y tortuosidad de las venas, acentuando la insuficiencia al distender el anillo de implantación de los velos valvulares. Esto se denomina la teoría centrífuga de la insuficiencia venosa y explica muy bien la incompetencia y la progresión de las várices de proximal a distal. Existirían puntos de escape del sistema venoso profundo al superficial a través de las válvulas safenofemoral y safenopoplíteas. Sin embargo, también existe progresión varicosa desde distal a proximal, documentada extensamente con los estudios más recientes con doppler color. En este caso la poderosa bomba muscular periférica comprime rítmicamente el sistema venoso profundo alcanzando presiones de hasta 150 mmHg, que se transmitirían al superficial a través de perforantes insuficientes. Tendríamos aquí un segundo punto de escape de las presiones del sistema venoso profundo al superficial, que ocasionarían varicosidades de distal a proximal. Esta sería la teoría centrípeta de la insuficiencia venosa progresiva (4).
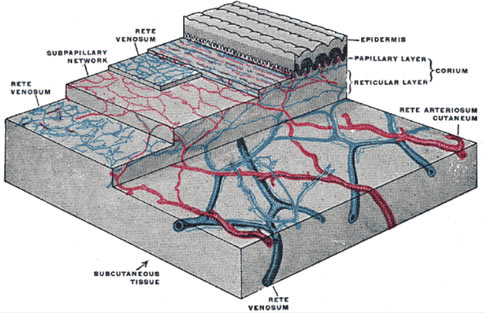
Finalmente, y gracias a los estudios ultrasonográficos y de transiluminación, sabemos que las várices reticulares y las telangiectasias representan puntos de escape de la presión de venas superficiales o reticulares a vénulas del dermis o a las telangiectasias (arañas vasculares) de la epidermis. Este tipo de várices dérmicos representan alrededor del 70% de todas las várices (5).
Estudio
Comienza con la anamnesis, que debe registrar los antecedentes de várices y patología venosa de cualquier tipo en el grupo familiar y sigue en lo personal con la edad de aparición, factores de riesgo como obesidad, multiparidad, bipedestación prolongada o posición sentada prolongada. Habitualmente hay un período prolongado asintomático para luego comenzar con dolor en piernas y tobillos, que aparece en el transcurso del día y se acentúa en la tarde, sensación de pesantez en las extremidades, fatiga precoz, calambres nocturnos, prurito e hiperestesia cutánea. Estos síntomas desaparecen o se alivian con el decúbito.
El examen físico debe hacerse de pie, con las extremidades descubiertas y buena iluminación que permita la inspección anterior y posterior. Debe describirse los paquetes varicosos, cicatrices o presencia de úlceras, hiperpigmentación en tobillos, lipodermatoesclerosis y atrofia blanca.
En la práctica moderna los exámenes están circunscritos al Doppler color venoso(6). Nos informa de la anatomía de las venas superficiales y profundas, reflujos longitudinales en los sistemas safenos, estado del sistema venoso profundo y reflujos horizontales en venas comunicantes y perforantes (7). Otros exámenes no invasivos como fotopletismografía y neumopletismografía no aportan datos importantes al estudio de la insuficiencia venosa superficial. Exámenes invasivos como la flebografia ascendente y descendente sólo se justifican en el estudio del sistema venoso profundo.
Indicación quirúrgica
Gran cantidad de pacientes consultan en la etapa asintomática, afligidos por la apariencia protuberante de los paquetes varicosos y las manchas flebectáticas. En tales ocasiones el sufrimiento psicológico puede ser una legítima indicación quirúrgica. Una buena historia clínica muchas veces revela síntomas que el paciente no relacionaba con sus várices. En presencia de los síntomas descritos más arriba la indicación quirúrgica es indudable. Contra lo que se sostiene habitualmente, las telangiectasias producen síntomas, particularmente pesadez, fatiga precoz y especialmente hiperestesia cutánea. Al realizarse el tratamiento adecuado estos síntomas desaparecen.
Otras indicaciones son la tromboflebitis superficial en paquetes varicosos, la tromboflebitis ascendente de la safena interna, varicorragias, particularmente en ancianos, estigmas cutáneos de insuficiencia venosa crónica, como hiperpigmentación maleolar, lipodermatoesclerosis, atrofia blanca, úlceras o cicatrices de ulceraciones pasadas.
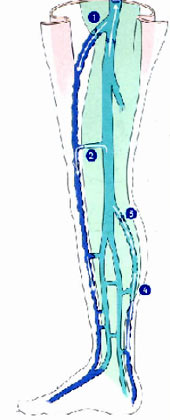
La cirugía está dirigida a eliminar los reflujos longitudinales de las safenas, los horizontales de las perforantes y la extirpación de los paquetes varicosos dejando la menor cantidad posible de cicatrices. Desde los trabajos de Hach (8) sabemos que los puntos de escape del profundo al superficial en la safena interna llegan a un 60% en la unión safenofemoral agregándosele un15 a 20% desde el muslo hasta la cara interna de rodilla, a través de la comunicante de Hunter y las perforantes de Boyd y Dodd.
Los otros puntos de escape en la pierna son las perforantes superior, media e inferior de Cockett, que en realidad desembocan en la vena marginal posterior, o arcada posterior (vena de Leonardo de los argentinos) y no en la safena. Luego no hay razón para eliminar la safena interna bajo rodilla, más aún cuando la exéresis hasta el maléolo interno generalmente lesiona el nervio safeno interno, dejando disestesias muy molestas y prolongadas en la cara interna de la pierna (9).
En la actualidad, los procedimientos quirúrgicos están reducidos a la exéresis de la safena interna desde la ingle a bajo rodilla, la safena externa desde el pliegue poplíteo hasta la unión del tercio medio con el tercio inferior de la pierna, junto con la exéresis de las colaterales varicosas (flebectomias). En los últimos 5 años se han agregado la endoablación de las safenas con el láser y con la radiofrecuencia.
Técnica
Nos guiamos estrictamente por los hallazgos del Doppler color. Se marca con lápiz indeleble cuidadosamente todas las varicosidades y las perforantes. En ocasiones, se encuentra una unión safenofemoral incompetente que recibe una safena accesoria anterior insuficiente generando varicosidades por el muslo y pierna. La safena interna aparece delgada y suficiente. En ese caso ligamos y seccionamos el cayado de la safena y eliminamos la safena accesoria mediante flebectomias. No hay razón para exéresis de la safena interna.
En un tercio de casos la unión safeno femoral aparece competente y sólo el trayecto de la safena está insuficiente. Aquí no hay razón para eliminar el cayado y sólo extirpamos el trayecto de la safena afectada. Ante una safena interna o externa con cayado y trayectos insuficientes hacemos la exéresis hasta bajo rodilla usando la técnica de Andreas Oesch. Se efectúa la safenectomía mediante una invaginación proximal usando el bastón del autor que se saca bajo rodilla por cara interna, logrando un mínimo de trauma en esta operación. El mismo procedimiento se usa para la externa, que se saca en el tercio inferior de la pierna para evitar la lesión del nervio safeno externo. Luego extirpamos los paquetes varicosos mediante incisiones con agujas para pasar los ganchos de crochet. Se procede al cierre de las incisiones y al vendaje compresivo elástico (10).
El paciente es dado de alta entre 4 a 6 horas a su domicilio. La tolerancia es excelente. Al alta, se coloca una dosis profiláctica de una heparina de bajo peso molecular y se indica deambulación a la mañana siguiente bajo vendas elásticas. Frente a reflujos horizontales, esto es, perforantes insuficientes, se marcan previamente bajo Doppler color y luego en el tiempo operatorio hacemos la ligadura selectiva y sección sobre la aponeurosis.
Esta técnica se usa en el Hospital del Salvador desde 1995 y al cabo de 10 años se habían operado sobre mil pacientes, con una recidiva varicosa de un 20% en casos seguidos 5 años. Eso está en el rango de lo publicado por la mayoría de los autores. Las recidivas varicosas operadas han sido excelentemente documentadas por Darke en el Reino Unido (11). En el 66% de sus casos encontró la causa de la recidiva en el segmento safenofemoral, ya sea por neovascularización de safenas a través de muñones largos de cayado, o de otras venas accesorias en muslo, o directamente por safenas internas no ligadas, probablemente duplicadas. El tercio restante correspondió a un 15% de safenas externas insuficientes y el resto a perforantes insuficientes.
Láser y radiofrecuencia
Hace aproximadamente 7 años apareció una técnica de ablación de las safenas introduciéndoles una fibra óptica a través de la cual se pasa un rayo láser. La longitud de onda usada inicialmente (810 nanometros) logra que la hemoglobina absorba la energía del láser y se caliente, formando burbujas que van a chocar y transmitir este calor a la íntima y media de la vena. El resultado es la destrucción térmica de la vena sobre la fibra, que se va retirando gradualmente dejando un pequeño lumen que se trombosa. La industria produce nuevos láseres con mayor longitud de onda, que ahora son capaces de calentar sangre y plasma, provocando una mayor y quizás más segura termoablación de la vena.
La modalidad norteamericana consiste en puncionar la safena a nivel de la cara interna de la rodilla, pasar un catéter que se detiene 2 cms antes de llegar al cayado, controlado por Doppler color, introducir la fibra por el catéter e infiltrar todo el trayecto de la peri vena con una solución de suero fisiológico frío más lidocaína al 0.1%, usando entre150 a 300 ml. Ésta es la llamada anestesia por tumescencia, destinada a una efectiva analgesia y a comprimir la vena sobre la fibra del láser, para una mejor ablación. Se procede a disparar retirando 2 cms por seg. la fibra, usando 14 Watt de potencia. Con esta técnica se entregan aproximadamente 70 Joules por cm. de vena, lo que asegura su destrucción. Desde hace un año usamos un láser de 940 nanometros siguiendo la modalidad norteamericana, sin abrir la zona inguinocrural para evitar la neovascularización. El seguimiento lo realizan los autores según el porcentaje de oclusión total o parcial de la safena. Las colaterales son esclerosadas posteriormente o en algunos casos ablacionadas con fibras más delgadas (12).
La radiofrecuencia consiste en la inserción de un catéter usando la técnica de Seldinger, a nivel de la cara interna de la rodilla y llevándolo hasta 2 cms. antes de alcanzar el cayado de la safena interna. Posteriormente se infiltra el trayecto de la vena con una solución fría entre 150 a 250 ml. de lidocaína al 0.1%. Este catéter posee en la punta electrodos que se abren y tocan directamente la íntima. Al disparar se entrega corriente eléctrica alterna de alta frecuencia que se convierte en calor alcanzando un máximo de 85*C, destruyendo así el tejido venoso hasta una profundidad de 2 mm. La ablación térmica de la íntima se acompaña de contracción de la media, que cierra el lumen alrededor del catéter. Éste se va retirando a 2-3 mm por segundo lográndose el cierre completo de la safena. El catéter es poco flexible para introducirlo en las ramas, luego su indicación es sólo para los troncos safenos (13).
Esclerosis
Desde que se inventó la jeringa el Hombre ha inyectado todo tipo de substancias a las várices para conseguir su desaparición. Según su tipo de acción se clasifican en:
1. Osmóticos – NaCl al 23.4%, Glucosa 65%, Salicilato de Sodio.
2. Detergentes – Tetradecyl Sulfato de Sodio (Sotradecol), Polidocanol (Etoxisclerol), Morruato de Sodio.
3. Corrosivos –Yoduro de Sodio, Yoduro de Potasio, Alcohol Benzílico, Glicerina Crómica (Scleremo).
En nuestro medio se prefiere el Polidocanol por su ausencia de complicaciones, particularmente las reacciones alérgicas. En general, las reacciones anafilactoídeas son las más temibles porque pueden implicar riesgo vital.
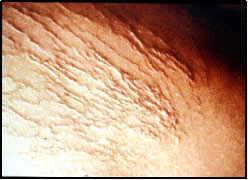
Las concentraciones son propias de cada agente esclerosante, pero debe tenerse en cuenta que a menor diámetro del vaso menor es la concentración a usar. Igualmente debe considerarse que frente a insuficiencia de cayados, inyectar troncos safenos o sus ramas está acompañado de tasas de recidiva varicosa a los 2 años de sobre el 60%. Tampoco se aconseja la inyección de perforantes insuficientes, salvo por especialistas muy avezados en estas prácticas. Hay un fuerte riesgo de provocar TVP por paso del agente esclerosante al SVP.
Nuestra práctica está restringida a telangiectasias, várices reticulares y colaterales varicosas residuales. En casos especiales de pacientes muy añosos o ulcerados con comorbilidades que desaconsejan la cirugía incluso con láser, efectuamos la endoablación química con espuma ecoguiada de troncos safenos insuficientes. Se usa un catéter introducido según la técnica de Seldinger en la safena, bajo visión con ecodoppler, que se avanza hasta medio muslo. Se comprime la región inguinal y se inyecta polidocanol al 2 o 3%, según el diámetro del vaso, convertido en espuma según el método de Tessari.
Se controla por el Doppler color que la vena esté llena de espuma y se venda la extremidad con medias o vendas elásticas de alta compresión, que se mantiene mínimo una semana. El uso de agentes esclerosantes en forma de espuma es reciente. Fue inventado por Cabrera en España y perfeccionado por Tessari de Italia y divulgado por Monfreux en Francia. Tiene la ventaja de aumentar la superficie de contacto del medio con la íntima de la vena a través de las burbujas y conseguir así mejores resultados de oclusión de los vasos.
Complicaciones (14)
1. Pigmentación., – aparece en un 10 a 30% de los casos y está relacionado con la concentración del agente usado. En la mayoría de los casos desaparece en 1 o 2 años.
2. Dolor, edema. – en el sitio de punción. Desaparece en 30 minutos a 1 hora.
3. Equimosis. – Aparece en un 20% aproximado de las inyecciones. Desaparece a las 2 o 3 semanas.
4. Tromboflebitis. – La inyección de un esclerosante suele producir una inflamación aguda de la vena. Se forma un trombo que puede comprometer otras venas a distancia. Para prevenir esta complicación se recomienda usar pequeños volúmenes, no más de 0.5 ml, y comprimir la extremidad.
5. Necrosis cutánea. – Habitualmente se debe a concentración alta del esclerosante, extravasación durante la inyección, inyección muy rápida o inyección en una arteriola cutánea (araña vascular roja).
6. Inyección frustra. – Se observa persistencia de la vena. Generalmente se reinyecta con una mayor concentración.
7. Trombosis venosa profunda. – Debe evitarse inyectar grandes cantidades de esclerosante y conseguir deambulación inmediata. Complicación no habitual.
8. Matting. - Desarrollo de un área rojiza de vasos sanguíneos muy finos alrededor de un sitio de punción. Ocurre en 10 a 30% de pacientes tratados por telangiectasias y en un 15% por vasos más gruesos. Muy difícil de tratar, pero suele resolverse espontáneamente dentro del año. A veces puede recurrirse al Láser cutáneo. Factores de riesgo son los tratamientos hormonales concomitantes y la obesidad.
9. Reacciones anafilácticas. – Suelen ser muy graves. Debe tenerse a mano siempre oxígeno, adrenalina y esteroides inyectables endovenosos.
10. Manifestaciones visuales. – Raramente suelen ocurrir cefaleas, visión de luces brillantes, mareos e hipotensión.
11. Inyección intraarterial. – Considerando que suele terminar en gangrena de la extremidad, esta complicación es extremadamente seria. Debe tenerse siempre en cuenta en áreas riesgosas, p.ej. la arteria tibial posterior, la zona de la unión safenofemoral y safenopoplítea.
Referencias
1. Burkitt DP (1972) Varicose veins, DVT and Hemorrhoids: Epidemiology and suggested etiology. Br.Med.J. 2, 556.
2. Arnoldi CC (1957) The etiology of primary varicose veins. Dan. Med.Bull. 6, 102-7.
3. Rose SS, Ahmed A (1985) Some thoughts on the etiology of varicose veins. Int .J. Cardiovasc. Surg. 27, 584-93.
4. Bergan JJ, (1995) Causes of venous varicosities and telangiectasias: implications for treatment. J. Vasc. Biol. Med. (in press).
5. Weiss RA, Weiss MA (1990) Resolution of pain associated with varicose and telangiectatic leg veins after compression sclerotherapy. J. Dermatol. Surg. Oncol. 16, 333-6.
6. van Bemmelen PS, Bedford G, Beach K, Strandness DE Jr (1989) Quantitative segmental evaluation of venous valvular reflux with ultrasound scanning. J. Vasc. Surg. 10, 425-31.
7. Coleridge-Smith P, Labropoulos N, Partsch H, Myers K, Nicolaides A, Cavezzi A. Duplex ultrasound investigation of the veins in chronic venous disease of the lower limbs – UIP Consensus. Part 1- Basic principles. Eur J Vasc Endovasc Surg Jan 2006; 31(1):83-92.
8. Hach-Wunderle V (1992) Die secundare popliteal und femoralvenen-insuffizienz.
Phlebologie 21, 52-8.
9. Conrad P ( 1992) Groin to knee down stripping of the long saphenous vein. Phlebology 7, 20-2.
10. Goren G, Yellin AE (1994) Invaginated axial saphenectomy by a semirigid stripper: Perforate-Invaginate stripping. J. Vasc. Surg. 20, 970-77.
11. Darke SG (1992) The morphology of recurrent varicose veins. Eur. J. Vasc. Surg. 6, 512-17.
12. Zimmet SF Endovenous laser ablation. Phlebolymphology 2007, 14:51-8.
13. Merchant RF, Pichot O, Myers KA. Four year follow up on endovascular radiofrequency obliteration of great saphenous reflux. Dermatol Surg Feb 2005; 31(2):129-34.
14. Goldman MP (1995) Sclerotherapy Treatment of Varicose and Telangiectatic Leg Veins, 2nd Ed. Mosby Yearbook, St Louis.